自武汉市暴发新型冠状病毒以来,各方人士全球调配资源,将世界各地的各种口罩捐赠到武汉,由于境内外口罩标准各异,为更好地帮助医护人员选择合适的口罩,且不轻易浪费医用耗材,本文对比了境内外口罩标准,并就新型冠状病毒传播途径,以及各类型口罩临床应用场景进行分析,力图为正确佩戴口罩提供参考。
新型冠状病毒防护口罩要求
新型冠状病毒的传播途径 根据国家卫生健康委员会2020年2月19日发布的《新型冠状病毒肺炎诊疗方案(试行第六版)》,经呼吸道飞沫和密切接触传播是新型冠状病毒主要的传播途径,在相对封闭的环境中长时间暴露于高浓度气溶胶情况下存在经气溶胶传播的可能。因此,防止飞沫传播成为阻挡新型冠状病毒传播的关键。
新型冠状病毒的口罩防护 含病毒的飞沫或飞沫核被人吸入后,会附在上呼吸道上或随气流一同进入肺部,从而造成感染。根据国家卫生健康委疾控局发布的《预防新型冠状病毒感染的肺炎口罩使用指南》,口罩是预防呼吸道传染病的重要防线,可以降低新型冠状病毒感染风险。口罩不仅可以防止病人喷射飞沫,减少飞沫量和降低喷射速度,还可以阻挡含病毒的飞沫核,防止佩戴者吸入。因此佩戴口罩成为防止病毒传播的重要防护措施。
口罩滤料的过滤机理 国家药品监管部门发布的《医用口罩产品注册技术审查指导原则》说明,口罩滤料的过滤机理主要有四种:扩散沉积、静电吸引沉积、截留沉积、惯性沉积。沉积颗粒越小时,扩散沉积、静电吸引沉积效应越强;颗粒越大时,截留沉积、惯性沉积效果越好;并非越小的颗粒越难被过滤。综合4种过滤机制的协同作用,普通机械性滤料最易穿透粒径的范围是0.1µm~0.3µm。
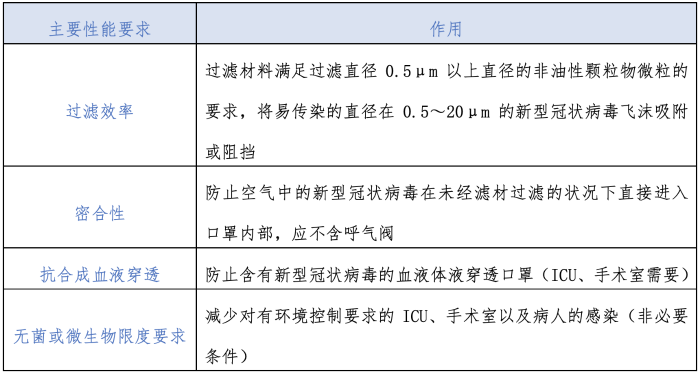
新型冠状病毒的防护口罩基本要求 新型冠状病毒颗粒直径为60nm~140nm,附着在飞沫上传播,患呼吸道疾病的患者在进行各种呼吸行为时,会产生各种尺寸飞沫释放到空气中。由于采用不同的实验测试方法,国内外不同文献得到的飞沫粒径分布的实验数据存在很大的差异。但总体来说,直径大于20μm的飞沫会迅速沉降,直径在0.5μm~20μm的飞沫会悬浮在空气中并被易感人群吸入。飞沫是一种非油性颗粒物。因此,适合防护新型冠状病毒感染的口罩,必须能够满足过滤直径0.5μm以上直径的非油性颗粒物微粒的要求,才能有效阻挡飞沫,起到保护作用。
新型冠状病毒的防护口罩其他要求 新型冠状病毒防护口罩除需要满足非油性颗粒物的基本要求外,应按顺序满足以下要求:密合性、抗合成血液穿透、无菌或微生物限度要求。口罩按形状分为平面形及立体型,立体型又分为鸭嘴形、拱形或折叠式三种,平面口罩的密合性达不到要求,应选用立体型口罩防护。抗合成血液穿透为ICU、手术室使用口罩的必要条件,在ICU、手术室等进行有创操作或患者呼吸道有喷溅物的时候需要。境外外科口罩虽多为非无菌提供,但其能严格把关原材料供应商的管理控制和十万级净化车间口罩生产的过程控制。在当前应急环境下,境外外科口罩的无菌提供或有微生物限度要求为非必要条件。此外,根据《GB 19083-2010医用防护口罩》,口罩应用于医院不应有呼气阀。
因此,本文在分析当前新型冠状病毒特点的基础上,梳理出临床适用的口罩主要性能要求(见表1),未囊括口罩其他的设计技术要求。
表1 新型冠状病毒防护口罩要求
境内各标准口罩的应用分析
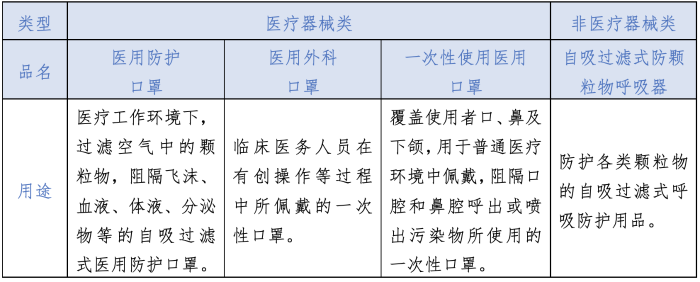
各标准口罩用途对比 目前,境内口罩共有四种标准:医疗器械类包括医用防护口罩、医用外科口罩、一次性使用医用口罩;非医疗器械类包括自吸过滤式防颗粒物呼吸器。根据对各类型口罩国家标准及行业标准对产品的用途描述,本文进行了如下对比(见表2)。从用途上来讲,只有医用防护口罩和自吸过滤式防颗粒物呼吸器是满足防护飞沫或颗粒物防护要求的。
表2 境内各类型口罩用途对比
境内各标准口罩性能指标分析 本文对《GB 19083-2010医用防护口罩技术要求》《YY 0469-2011医用外科口罩》《YY/T 0969-2013 一次性使用医用口罩》《GB 2626-2006 呼吸防护用品 自吸过滤式防颗粒物呼吸器》四项国家标准中的过滤效率、密合性、合成血液穿透、微生物指标四项关键性能指标进行了对比(见表3)。
对比发现,符合GB 19083-2010过滤性能的最低标准,就相当于GB 2626的KN95标准,医用防护口罩、KN95和KN100自吸过滤式防颗粒物呼吸器符合非油性颗粒过滤效率95%以及密合性的要求,满足当前病毒防护的要求。医用防护口罩、医用外科口罩具备抗合成血液穿透的能力,满足有血液喷溅、体液喷出的ICU、手术室病毒防护的要求。除自吸过滤式防颗粒物呼吸器外,其余三种类型口罩均有微生物指标的要求,满足医疗机构无菌区要求。
表3 境内各标准口罩性能及要求对比
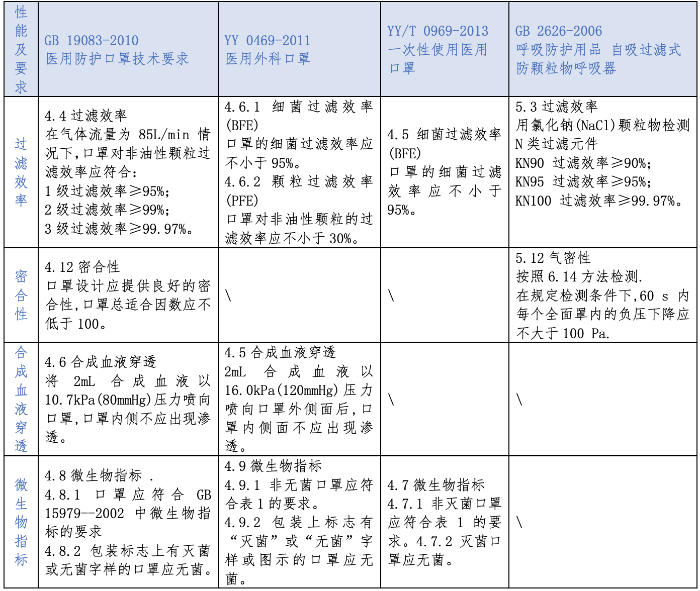
(编者注:表中所指“表1”内容为“细菌菌落总数≤100CFU/g,大肠菌群、绿脓菌群、金黄色葡萄球菌、溶血性链球菌、真菌不得检出。”)
境内各标准口罩应用场景分析 通过对各口罩标准对比,结合表1新型冠状病毒防护口罩要求,笔者认为,医用防护口罩适用于包括ICU、手术室在内的需要新型冠状病毒防护的医院所有场景;KN95、KN100自吸过滤式防颗粒物呼吸器(鸭嘴形、拱形或折叠式)因不具备抗合成血液穿透的能力,但具备非油性颗粒过滤能力(≥95%),适用于有血液喷溅、体液喷出的ICU、手术室之外需要新型冠状病毒防护的医院所有场景;医用外科口罩对非油性颗粒的过滤效率要求为不小于30%,在武汉所有医院均收治新冠肺炎患者的情况下,仅适用于普通门诊、普通病房场景;一次性使用医用口罩不具备非油性颗粒过滤要求,在需要新型冠状病毒防护的医院所有场景均不适用。
境外各标准口罩的应用分析
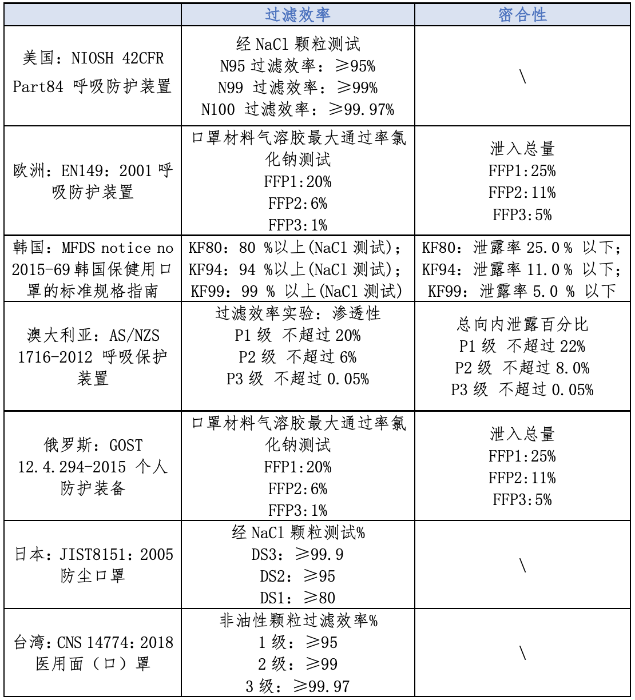
境外口罩过滤效率及密合性指标对比 结合表1新型冠状病毒防护口罩要求,考虑到境外口罩标准大部分无微生物指标,本文对境外口罩非油性颗粒过滤效率及密合性两项关键性能指标进行对比(见表4),包括美国《NIOSH 42CFR Part84 呼吸防护装置》、欧洲《EN149:2001呼吸防护装置》、韩国《MFDS notice no 2015-69韩国保健用口罩的标准规格指南》、澳大利亚《AS/NZS 1716-2012 呼吸保护装置》、日本《JIST8151:2005防尘口罩》、俄罗斯《GOST 12.4.294-2015个人防护装备》、台湾地区《CNS 14774:2018医用面(口)罩 》七项标准。
对比发现,欧洲FFP2、FFP3,韩国KF94、KF99,澳大利亚P2、P3,俄罗斯FFP2、FFP3口罩满足非油性颗粒过滤效率95%以上和密合性的标准要求;美国N95、N99,日本DS2、DS3,台湾地区1级、2级、3级口罩满足非油性颗粒过滤效率的要求,但是无密合性要求,在使用时应选用鸭嘴形、拱形或折叠式等密合性强的口罩类型。
表4 境外口罩标准对比
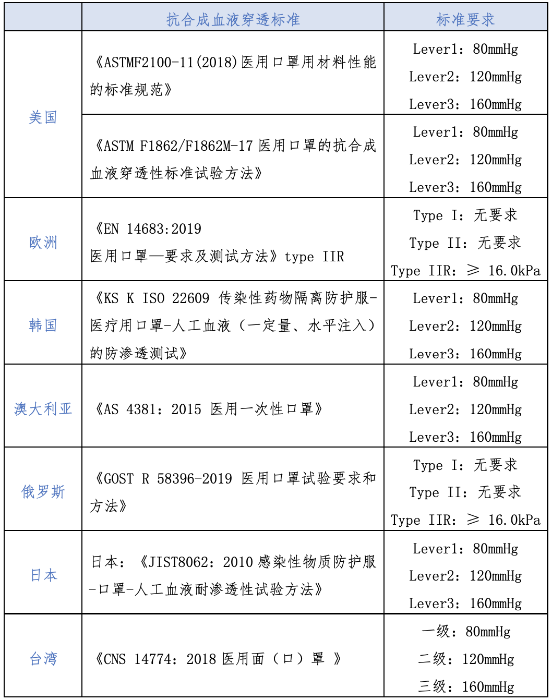
境外口罩抗合成血液穿透指标对比 结合表1新型冠状病毒防护口罩要求,考虑到抗合成血液穿透指标在境外标准中属于单项设置,本文对境外产品合成血液穿透相关标准进行了对比(见表5),包括美国《ASTMF2100-11(2018)医用口罩用材料性能的标准规范》《ASTM F1862/F1862M-17医用口罩的抗合成血液穿透性标准试验方法》、欧洲《EN 14683:2019医用口罩—要求及测试方法》、韩国《KS K ISO 22609 传染性药物隔离防护服-医疗用口罩-人工血液(一定量、水平注入)的防渗透测试》、澳大利亚《AS 4381:2015 医用一次性口罩》、俄罗斯《GOST R 58396-2019医用口罩试验要求和方法》、日本《JIST8062:2010感染性物质防护服-口罩-人工血液耐渗透性试验方法》、台湾地区《CNS 14774:2018医用面(口)罩 》七项标准。
对比发现,满足美国、韩国、澳大利亚、日本、台湾地区标准Lever1的,符合《GB 19083-2010医用防护口罩》的合成血液穿透指标(80mmHg);满足美国、韩国、澳大利亚、日本、台湾地区标准level 2的,以及欧洲、俄罗斯的type IIR等级标准的,符合《YY0469-2011医用外科口罩》的合成血液穿透指标(120mmHg)。
表5 境外口罩抗合成血液穿透标准对比
根据上述分析可知,海内外捐赠、销售或采购到武汉临床使用的口罩,按照是否是医疗器械区分,分为属于医疗器械的医用口罩,和不属于医疗器械的民用口罩;按照医疗机构是否可用区分,既有属于医疗器械、但不适用于医疗机构的一次性医用口罩,也有不属于医疗器械、但可用于医疗机构的民用呼吸防护口罩。因此,用于新型冠状病毒防护的口罩,在当前防疫形势下,是否适用于医疗机构,不能仅从是否是医疗器械进行区分,而是应当按照口罩的性能指标,结合医疗机构适用场所进行指导使用,实现物尽其用、精准对接。
本文对于临床使用的新型冠状病毒防护口罩类型作出如下结论:
境内KN95、KN100民用呼吸防护口罩(适用标准为GB 2626-2006)应不含呼气阀,适用于ICU、手术室之外需要新型冠状病毒防护的医院所有场景。满足美国N95、N99,欧洲FFP2、FFP3,日本DS2、DS3,韩国KF94、KF99,澳大利亚P2、P3,俄罗斯FFP2、FFP3,以及台湾1级、2级、3级(应为鸭嘴形、拱形或折叠式)标准的口罩,为境外同级口罩。
境内医用外科口罩(适用标准为YY 0469-2011)适用于普通门诊、普通病房的医院场景。满足美国、韩国、澳大利亚、日本、台湾level 2、level3标准,及欧洲、俄罗斯type IIR标准等合成血液穿透要求的口罩,为境外同级口罩。
境内医用防护口罩(适用标准为GB19083-2010)适用于医院需要新型冠状病毒防护的所有场景。同时满足医用外科口罩、KN95、KN100民用呼吸防护口罩标准要求的境外同级口罩,可视同满足境内医用防护口罩标准要求,适用于医院需要新型冠状病毒防护的所有场景。
紧急情况时KN95、KN100民用呼吸防护口罩与医用外科口罩搭配使用,接近于医用防护口罩功能,适用于医院需要新型冠状病毒防护的所有场景。
一次性使用医用口罩(适用标准为YYT 0969-2013)在医院需要新型冠状病毒防护的所有场景均不适用。
(作者单位:湖北省武汉市市场监督管理局、上海市药品监督管理局)