根据《医疗器械注册管理办法》(国家食品药品监督管理局令第16号)和《医疗器械临床试验规定》(国家食品药品监督管理局令第5号)(以下简称《规定》)的要求并结合弹性印模材料产品的特点,为指导该类产品临床试验方案的制定和规范技术审查工作,特制定本规范。
弹性印模材料包括弹性体印模材料和水胶体印模材料。弹性体印模材料,包括硅橡胶(缩合型和加成型)印模材料、聚醚橡胶印模材料和聚硫橡胶印模材料;水胶体印模材料,包括藻酸盐印模材料和琼脂印模材料。本规范适用于弹性体印模材料临床试验方案的制定,水胶体印模材料也可参照使用。
一、临床试验的题目
该类临床试验的题目为“弹性体印模材料临床试验试验方案”(以下简称“临床试验试验”)。
二、临床试验试验的背景
(一)国内外同类产品上市、使用的情况;
(二)受试产品执行的标准;
(三)临床观察指标的确定依据及其与临床应用的相关性;
(四)产品型式试验和生物相容性评价的情况。
三、受试产品的产品描述
受试产品一般应结合自身特点,明确其主要成分、作用机理、技术特点、适用范围及禁忌症等,例如:
(一)主要成分及作用机理
由基质、交联剂、催化剂、填料等组成;作用机理为形成印模的聚合反应方式。
(二)技术特点
亲水性能、固化后尺寸稳定性等。
(三)适用范围及禁忌症
固定修复体、可摘义齿、咬合记录、种植修复体等,禁忌症(如口腔粘膜病、过敏及其他不适宜使用此产品制取印模的疾患等)。
四、临床试验的目的、内容
(一)目的
通过临床试验及必要的实验室方法,采取与已国内上市同类产品临床对比的途径,来证明受试产品与已上市同类产品实质性等同,以便验证受试产品的临床有效性和安全性。
(二)内容
1.调和性能:各组分是否能在规定的时间内混合均匀;
2.工作时间:印模材料从调和到开始出现弹性的时间。观察印模材料在规定的工作时间上限是否有可塑性;
3.固化时间:印模材料从调和到完全固化形成口腔印模以及咬合记录所需时间,是否在规定时间之内;
4.操作性能:粘稠度、脱模情况、从患者口腔取出印模的难易程度及形状的完整性等;
5.口腔粘膜刺激及过敏:检查受试者在规定的临床观察期间内,是否因印模材料导致口腔粘膜刺激症状及过敏等不良反应(如接触区粘膜充血、溃疡等);
6.复制性能:包括复制口腔印模及由印模翻制的石膏模型的性能。
推荐使用模型测量法(见附件1)。
五、总体设计
(一)临床试验的流程、设置观察点及观察记录等(参见临床试验流程图)。
(二)评价标准
对临床试验所规定的观察点,应当制定定性或定量的评价标准。
(三)确定主要临床评价指标
在对受试产品临床试验中的各项评价指标分析研究的基础上,进一步确定主要临床评价指标。主要临床评价指标应对其他各项评价指标具有相关性、综合性的特点。牙科弹性体印模材料的复制性能,是除生物相容性以外其他各项评价指标的最终结果,与其他评价指标具有很强的相关性、综合性。同时,也是受试产品有效性的集中体现。
(四)受试者的选择(见附件3)
(五)临床试验持续时间及确定理由
临床试验持续时间,是受试产品的使用时间与临床观察时间的总和。临床观察时间可参照行业标准(YY/T 0279-1995 口腔材料生物试验方法口腔粘膜刺激试验),最多一般不多于2周。
应制定临床随访的时间、方式、次数。
(六)副作用的预测及应采取的措施
应充分考虑临床试验中和临床试验后有可能出现的副作用,并制定需要采取的措施,包括终止试验、予以相应治疗以及启动“不良事件报告程序”等。
(七)受试者的数量
设定检验水准α=0.05,检验效能1-β=0.9;参照YY0493-2004 牙科学 弹性体印模材料的线性尺寸变化的规定、牙冠修复体密合度的临床要求和预试验中复制性能的结果,规定Lx(左右第七颗牙颊侧间的距离)等效界值ΔLx=0.40mm,Ly(左右第七颗牙远中面与中切牙颊侧间的距离)等效界值ΔLy=0.28mm。采用配对设计的等效性t检验方法,估计受试者的数量(见附件2)。综合考虑调和性能、工作时间、操作性能、生物相容性四项计数评价指标,两家临床试验机构的受试者数量不少于60人。
(八)统计方法的选择
将受试产品所复制的模型和对照产品所复制的模型,按照附件1的方法进行测量,经测量信度分析(见附件4),其测量数据的组间相关系数不低于0.9999的数据,采用配对设计的等效性t检验方法(见附件5)。
六、受试者知情同意书
受试者知情同意书,应符合《规定》第二章的要求。
七、 各方责任书
各方责任书所规定的临床试验实施者的责任应符合《规定》第四章医疗器械临床试验实施者的要求;医疗机构及临床试验人员的责任应符合《规定》第五章医疗机构及医疗器械临床试验人员的要求。
八、临床试验结论
承担临床试验的医疗机构,根据临床试验的观测记录,按照《规定》中第六章的相关要求,出具临床试验结论。
九、临床评价标准
口腔粘膜刺激及过敏的合格率应为100%;
固化时间的合格率应为100%;
受试产品的复制性能与对照产品的复制性能为等效。
调和性能、工作时间、操作性能的项目可按照实际项目进行描述评价。
附件1:弹性体印模材料印模精度试验(模型法)操作步骤
一、模型制备
(一)采用单盲法,将对照产品和受试产品按照设定的随机排列表在受试者口腔内分别制取印模。用对照产品制取的为印模1,用受试产品制取的为印模2。
(二)在规定的操作时间内将印模1、印模2,分别翻制成模型1、模型2。
二、测量器具
测量精度为0.001mm的工具显微镜(图1)。

三、测量步骤
对模型测试者采用单盲测试
(一)模型预备

使用样品平行度调整器(图2),通过硬石膏材料调整模型的基准面。基准面调整前的模型(图3)。基准面调整后的模型(图4)。
(二)测量
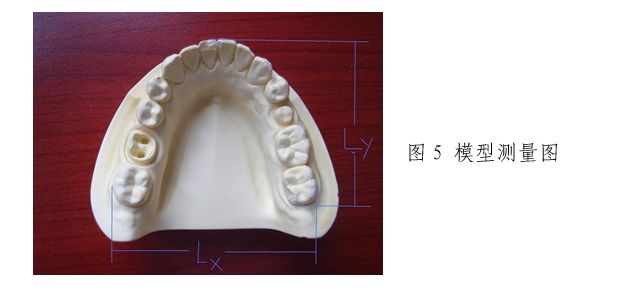
按照模型测量图(图5)标示,分别测量模型1、模型2的Lx和Ly的值。每个参数测量5次,计算其平均值及标准差并记录。
附件2:受试对象例数的估算
根据预试验的结果,采用配对设计的等效性t检验公式的逆运算进行估算:

附件3:受试者的选择
受试者的选择和排除标准应通过伦理委员会的认可,建议可参考以下内容:
(一) 年龄在18-70岁之间者,性别不限;
(二)根据受试产品预期用途选择受试患者,要求下颌中切牙、双侧第二磨牙健在。例如,预期用途覆盖固定修复体时,选择拟行全冠修复的患者(不包括联冠)。
(三)行动自如,能够配合完成临床试验。
注:有以下情况之一者不被列入受试者范围
(一)过敏体质或多种药物过敏者;
(二)口腔黏膜病患者;
(三)妊娠妇女、意向妊娠育龄妇女,哺乳期妇女;
(四)传染性疾病;
(五)既往有免疫系统疾病病史的患者;
(六)进入研究前一个月内用过全身激素或其它免疫调节剂者;
(七)严重全身性疾病:严重肝肾功能不全,严重心肺功能不全;
(八)精神病患者;
(九)入选前三个月内曾参加其它材料临床试验者。
附件4:测量结果的信度分析
测定结果的信度可用组内相关系数(其数值在0~1之间分布)的大小进行表征。组内相关系数越趋近于1,说明信度越高,组内相关系数越趋近于0,说明信度越低。

附件5:配对设计的等效性t检验方法
将测量结果,用配对设计的t检验进行等效性统计分析:

(一)当检验统计量t ≥ t0.05 ,P ≤ 0.05,按α=0.05的水准,可认为受试产品等效于对照产品。
(二)当检验统计量t < t0.05 ,P > 0.05,按α=0.05的水准,则不能认为受试产品等效于标准印模材料。
《弹性体印模材料临床试验方案制定规范》
编制说明
一、任务来源及背景
弹性印模材料包括弹性体印模材料和水胶体印模材料,临床主要用于翻取病人口腔模型。
本规范的编写目的是指导和规范该类产品的技术审评工作,帮助审评人员理解和掌握该类产品原理/机理、结构、性能、预期用途等内容,把握技术审评工作基本要求和尺度,对产品安全性、有效性作出系统评价;同时也为了指导生产企业的产品注册工作。
二、需要说明的问题
(一)在规范编写的最初阶段,主要形成了“模型法”和“膜厚法”两种临床试验的方案。
“模型法”为临床取膜后,翻转成石膏模型,通过测量石膏模型来评价印模材。
“膜厚法”为临床取膜后,制作成单冠,将聚合材料涂抹于单冠内壁,再将单冠放置于取膜的牙上,待聚合材料凝固后取下单冠,取出单冠内由聚合材料形成的膜,通过测量膜厚来评价印模材。
经过会议讨论和预试验,本规范采取了“模型法”,理由如下:
1.“模型法”仅有翻模一步,中间工序较少,干扰因素较少;“膜厚法”制作成义齿后取膜,中间工序较多,干扰因素较多,如最终试验结果不理想,则很难断定是印模材的原因;
2.对两种方法分别进行预试验,“膜厚法”的试验数据离散性较大,不具有统计学意义。
(二)本规范中等效界值ΔLx=0.40mm,ΔLy=0.28mm。等效界值的确定经过了临床专家的反复讨论,主要考虑了预试验的结果和临床使用的实际需求。
(三)本规范在设计上采取了临床机构取模,检测机构测量的方案。主要原因如下:
1.测量所用的工具为高倍显微镜,且需要模型处理,整个测量过程比较复杂,如临床机构测量则很难保障测量的准确性;
2.检测机构测量一方面保障了测量的准确性,同时也保证了整个临床试验的公正性。
(四)附件3“受试者的选择”中第2条的设定,主要考虑到翻模后易于测量。